Elektrofilni i nukleofilni
Elektrofil i nukleofil su dva važna pojma u organskoj kemiji koja pomažu opisati kemijske reakcije između akceptora elektrona i donora. Ove dvije pojmove uvele su 1933. godine Christopher Kelk Ingold i služili su kao zamjene za kationoidne i anionoidne pojmove koje su 1925. godine uveli A.J. Lapworth.
Od tada su poduzete opsežne studije kako bi se razumjeli različiti između elektrofila i nukleofila. Ovaj članak demistificira razliku između ova dva pojma. Ukratko, nukleofil je donator elektrona, dok je elektrofil takav akceptor elektrona.
Što je elektrofilno?
Da bi slomio pojam, riječ "elektro" je od elektrona, a latinska riječ "filip" odnosi se na "ljubav". Jednostavno rečeno, to znači elektroni koji vole. To je reagens koji je karakteriziran niskom gustoćom elektrona u svojoj valentnoj ljusci i stoga reagira s molekulom, ionom ili atomom visoke gustoće da bi formirao kovalentnu vezu. Primjeri elektrofilnih tvari jesu vodik u kiselinama i metil-karbokacija. Oni su manjkavi elektronima.
Elektrofil se lako detektira pozitivnim nabojem ili neutralnim punjenjem s praznim orbitalima (koji ne zadovoljavaju pravilo okteta). Elektroni se kreću s područja visoke gustoće u onu s malom gustoćom, i za razliku od naboja privlače jedni druge. Ova teorija objašnjava atrakciju elektrona elektrofilnim atomima, molekulama ili ionima s manjkom elektrona. Prema definiciji, elektrofil se zamjenjuje Lewisovom kiselinom jer prihvaća elektrone u skladu s definicijom kiseline.
Reakcija i niži spojevi pokazuju primjere elektrofila:

U ovoj reakciji, ion hidroksida reagira s klorovodikom; tako se kiselina reagira s bazom. Kao što pokazuje strelica, više elektronegativni kisikov atom donosi elektrone elektronskom manjku atoma vodika. Dijeljen je usamljeni par atomu vodika koji ima pozitivan naboj u spoju klorovodika jer je više elektronegativan od vodika. Ova reakcija je temelj mnogih reakcija organske kemije, osobito Lewisove kiseline i Lewisove bazne reakcije. Ostali primjeri prikazani su na sljedećoj slici:
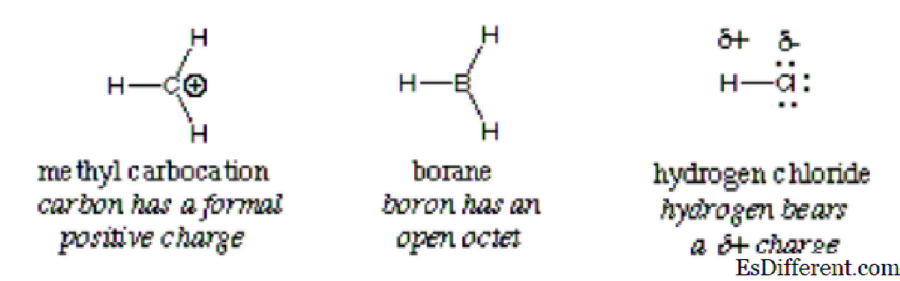
Općenito, elektrofil je identificiran djelomičnim pozitivnim nabojem kao u klorovodiku, formalnom pozitivnom naboju kao u metil karbokaciji ili slobodnim orbitalima. Polarizirane neutralne molekule kao što su acil halidi, karbonilni spojevi i alkil halogenidi su tipični primjeri elektrofila.
Važno: Hidronijev ion, iako ima pozitivan naboj, ne kvalificira se da se klasificira kao elektrofil, zbog punih slobodnih orbitala u vanjskoj ovojnici. On daje vodikov ion i vodu. Isto vrijedi i za amonijev ion; nema slobodnih orbita koji mogu privlačiti elektrone. Kao rezultat, to nije elektrofil.
Što je nukleofil?
Riječ je podijeljena u riječ "jezgra" koja se odnosi na jezgru i latinsku riječ "phile" što znači ljubav. To jednostavno znači jezgru koja voli. Nukleofili su bogati elektronima i, kao takav, doniraju parove elektrona elektrofilima da bi se formirale kovalentne veze u kemijskim reakcijama. Te tvari najbolje se primjećuju usamljenim parovima, pi-obveznicama i negativnim nabojima. Primjeri nukleofilnih tvari jesu amonijak, jodid i hidroksid.
Prema definiciji, nukleofil se zamjenjuje Lewisovom bazom, jer svi oni doniraju elektrone i prihvaćaju protone. Sljedeća slika prikazuje primjere nukleofila:

Nukleofilni centar u spoju detektira se s najelegantnijim atomom. Razmotriti amonijak NH3; dušik je više elektronegativan i tako privlači elektrone u središte. Spoj ima visoku gustoću elektrona, a kada reagira s elektrofilom, recimo vodom, donosi elektrone. H2O može djelovati i kao elektrofil ili nukleofil, ovisno o spoju ili molekuli s kojom reagira.
Razmotrite donju sliku:
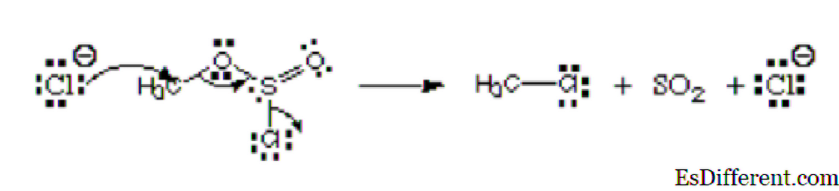
Iz slike, prvi atomi, ion klorida donosi svoj usamljeni par ugljiku da bi se formirala kovalentna veza. Ima negativni naboj i donira elektrone, pa se smatra nukleofilom. Taj atom klora koji napušta klorosulfit ester nazvan je odlazeća skupina. Nije elektrofil ili nukleofil.
Ključna razlika između elektrofila i nukleofila
Definicija elektrofila i nukleofila
Elektrofil je Lewisova kiselina koja prihvaća elektrone iz atoma, iona ili molekula bogatog elektronom. Prihvaćanjem elektrona, ona tvori kovalentnu vezu. Ovaj reagens često se identificira djelomičnim pozitivnim punjenjem, formalnim pozitivnim nabojem ili neutralnim atomom, ionom ili molekulom koja ne zadovoljava pravilo okteta. S druge strane, nukleofil je atom, ion ili molekula koja ima veliku gustoću elektrona. Donira usamljeni par elektrofilu da bi formirao kovalentnu vezu. Identificira se pomoću pozitivnih naboja i slobodnih elektrona u orbitalu.
Kemijske reakcije elektrofila i nukleofila
Nukleofil je uključen u nukleofilnu supstituciju i dodavanje dok je elektrofil uključen u elektrofilnu supstituciju i dodavanje.
Punjenje Identitet u elektrofilu i nukleofilu
Elektrofil može biti neutralno ili pozitivno napunjen, dok nukleofil može biti neutralno ili negativno napunjen.Elektrofil prihvaća elektrone, stoga se naziva Lewisovom kiselinom, dok nukleofil donosi elektrone pa se naziva Lewisovom bazom.
Elektrofilni stihovi Nukleofil: usporedni prikaz

Sažetak elektrofilnih stihova Nukleofil
- Elektrofil je atom, ion ili molekula manjkav elektroni, dok je nukleofil atom, molekula ili ion bogat elektronima
- Elektrofil može biti pozitivan ili neutriran, dok se nukleofil može negativno ili neutralno nabijati
- Elektrofil se naziva Lewisova kiselina i nukleofil se naziva Lewisova baza
- Elektrofil prihvaća elektrone i donira protone dok nukleofil donira elektrone i prihvaća protone.